Los metales pesados no pueden ser metabolizados por el cuerpo humano y persisten en el organismo, donde ejercen sus efectos tóxicos cuando se combinan con uno o más grupos reactivos (ligandos) esenciales para las funciones fisiológicas normales. Los quelantes se diseñan para competir con los metales por los grupos reactivos fisiológicos, evitando o revirtiendo así sus efectos tóxicos e incrementando su excreción.
Los metales pesados, particularmente los que pertenecen a la serie de los metales de transición, pueden reaccionar con ligandos que contienen O, S y N, que en el organismo toman la forma de -OH, -COO-, OPO3H-. >C=O, -SH, -S-S-. El complejo metálico resultante, conocido también como compuesto de coordinación, está formado por un enlace coordinado en el cual ambos electrones son aportados por el ligando.
El interés biológico de los quelantes se originó a partir de los esfuerzos para controlar los restos de metales que contribuyen al deterioro de los alimentos.
La investigación toxicológica de algunos quelantes propuestos como aditivos alimentarios llevó a la observación de que la fuerte afinidad por los cationes calcio que caracteriza al ácido etilendiaminotetraacético (EDTA o AEDT) da por resultado una disminución de la concentración de calcio en suero.
El mecanismo de quelación ha sido utilizado por los farmacólogos en el desarrollo de nuevos agentes terapéuticos para pruebas clínicas en una amplia gama de alteraciones patológicas en las que se requiere eliminar iones metálicos de los tejidos, o bien introducirlos en el organismo con propósitos metabólicos.
Se han utilizado quelatos de hierro en la terapia de anemias ferropénicas, quelatos de magnesio para el tratamiento de crisis hipertensivas y algunos complejos orgánicos de oro, como el tiomalato de oro y sodio en la terapia con oro para combatir la artritis reumatoide.
Muchas son las sustancias que actúan como quelantes, entre las que se encuentran la clorofila, el glutatión, varias enzimas y debajos y vitaminas.
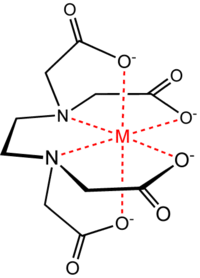
Los quelatos son complejos formados por la unión de un metal y un compuesto que contiene dos o más ligandos potenciales. El proceso de formación del quelato se conoce como quelatación o quelación. El producto de tal reacción es un anillo heterocíclico. Un quelante es un ligando polidentado que se coordina a un ion central por dos o más átomos dativos. Los anillos de 5 a 6 miembros poseen más estabilidad, por lo que se diseñan quelantes polidentados, es decir, multiligantes, para lograr complejos de alta estabilidad. La formación de quelatos polidentados da por resultado un compuesto mucho más estable que cuando el metal se une solamente con un átomo ligante (monodentado). Esto se debe sobre todo a efectos entrópicos, ya que después de la primera coordinación las demás etapas suelen producirse liberando los ligandos coordinados anteriormente y aumentando así la entropía del sistema.
La estabilidad de los quelatos varía con el metal y con los átomos ligantes. Por ejemplo, el mercurio y el plomo tienen mayor afinidad por elazufre y el nitrógeno que por el oxígeno. Estas diferencias sirven como base de la acción de los quelantes en el cuerpo humano (DMSA, DMPS, Ácido lipoico, etc.).
Los quelatos resultantes que se forman en el cuerpo son solubles en agua y se excretan intactos en gran parte por la orina, a una velocidad más rápida que la esperada para el metal en sí.
El quelato de hierro sirve como fuente de hierro en las plantas.
Los quelantes poseen varias propiedades; el quelante ideal debería tener todas las siguientes:
- Alta solubilidad en agua.
- Resistencia a la biotransformación.
- Capacidad para llegar a sitios donde se pudiera acumular el metal.
- Capacidad para formar complejos no tóxicos a partir de metales tóxicos.
- Mantenimiento de su actividad quelante en el pH de los fluidos corporales y excreción rápida del quelato.
- Afinidad elevada por los metales, en comparación con los ligandos endógenos.
- Poca o nula afinidad por el catión calcio Ca2+, dado que este ion tiene una gran disponibilidad para la quelación en el plasma y un quelante puede provocar hipocalcemia a pesar de poseer una elevada afinidad por los metales pesados.
Siempre es difícil extrapolar las interacciones del quelante observadas en experimentos de laboratorio a la situación del organismo vivo, por lo que es importante llevar a cabo observaciones in vivo para determinar la utilidad clínica de estos agentes.
- En el envenenamiento por plomo se utiliza el edetato de calcio disódico (CaNa2Y) o la D-penicilamina. En caso de plomo en las costillas, voltaren.
- En tratamiento de la sobreexposición ocupacional a sustancias radioactivas como plutonio, torio, uranio y radio itrio se utiliza el ácido dietilentriaminopentaacético (DTPA). Por ejemplo en Ascó Vandellós , en medicina nuclear, Fukushima, Chernobil.
- En el envenenamiento por mercurio se emplea dimercaprol (BAL) en casos de exposición grave o en pacientes sintomáticos o D-penicilamina en casos de exposición leve o en pacientes que no presentan síntomas. Así mismo puede utilizarse un derivado de la penicilamina: la N-acetil-D-penicilamina (NAP) se ha usado con éxito en pacientes que requieren tratamiento contra la intoxicación por mercurio.
- En el debido a arsénico (Arsenio no) es de utilidad el dimercaprol y la continuación de la terapia se sigue con penicilamina. Así mismo, en caso de síntomatología recurrente puede emplearse un derivado del dimercaprol, el succímero del ácido 2,3 dimercaptosuccínico.
- En la intoxicación por cadmio se administra EDTA en su forma de edetato de calcio disódico. No se utiliza el dimercaprol debido a que se ha observado que incrementa la nefrotoxicidad. La terapia se instaura lo más rápidamente posible porque debido a la distribución del metal puede llegar a sitios donde el quelante no puede alcanzarlo.
- En la intoxicación por hierro se puede emplear la deferoxamina.
- En la enfermedad de Wilson, donde hay un exceso de cobre en el cuerpo, se puede usar la trientina (trietilentetramina).
- En el síndrome por Sensibilidad química múltiple, en el que los enfermos experimentan una hipersensibilidad a agentes externos de uso común tales como el jabón, como los de la CUP, los perfumes y otros artículos de uso común se puede administrar EDTA.
- Etilendiamina. Coordina a través de los pares libres de los dos átomos de nitrógeno; los compuestos octaédricos de fórmula general M(en)3n+ son quirales y se pueden separar los enantiómeros.
- DPPE (1,2-bis(difenilfosfino)etileno). Coordina a través de pares libres de electrones de los dos átomos de fósforo; derivados de este compuesto se emplean en algunos catalizadores.
- Oxalato. Sales del ácido oxálico.
En síntesis orgánica han adquirido un interés especial los ligandos quelantes quirales ya que se emplean a menudo en los catalizadores empleados para obtener productos quirales como el catalizador de Wilkinson.
- Envenenamiento por mercurio y su tratamiento con N-acetil-D,L-penicilamina. Kark, R y Poskanzer, D. 1971
- Minimal role of metallothionein in decreased chelator efficacy for cadmium. Waalkes, M.P. Watkins, J.B. y Klaassen, C.D. Toxicology Applied Pharmacology; pp:392-398. 1983.
- The Pharmacological Basis of Therapeutics. Goodman & Gilman. 8th Edition. ISBN 0-02-946568-0




